FDA adverte sobre riscos raros, mas sérios, de derrames e derrames nas paredes dos vasos sanguíneos com o medicamento para esclerose múltipla Lemtrada (alemtuzumab)
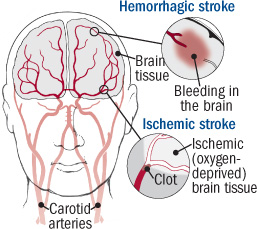
A Food and Drug Administration dos Estados Unidos (FDA) alerta que casos raros, mas sérios, de derrame e lágrimas no revestimento das artérias na cabeça e no pescoço ocorreram em pacientes com esclerose múltipla (EM) logo após receberem Lemtrada (alemtuzumab). Esses problemas podem levar à incapacidade permanente e até à morte. Como resultado, adicionamos uma nova advertência sobre esses riscos às informações de prescrição no rótulo do medicamento e ao Guia de Medicação do paciente. Também acrescentamos o risco de acidente vascular cerebral ao aviso em caixa existente, o aviso mais proeminente da FDA.

Alemtuzumab também é aprovado sob a marca Campath, que foi aprovado em maio de 2001 para tratar um tipo de câncer chamado leucemia linfocítica crônica de células B (B-CLL). O rótulo do medicamento Campath também será atualizado para incluir esses riscos na seção Reações Adversas em Experiência de pós-comercialização.
Os pacientes ou seus cuidadores devem
procurar tratamento de emergência o mais rápido possível se o paciente apresentar sinais ou sintomas de um derrame ou lágrimas no revestimento das artérias da cabeça e pescoço, chamadas de dissecção arterial, que podem incluir:
Dormência súbita ou fraqueza na face, braços ou pernas, especialmente se ocorrer em apenas um lado do corpo
Confusão súbita, dificuldade para falar ou dificuldade para entender o discurso
Repentina dificuldade em enxergar em um ou nos dois olhos
Problemas repentinos de andar, tontura ou perda de equilíbrio ou coordenação
Súbita dor de cabeça ou dor no pescoço
A maioria dos pacientes que tomavam Lemtrada, que desenvolveu derrame ou lágrimas nos revestimentos das artérias, desenvolveu sintomas dentro de 1 dia após o recebimento de Lemtrada. Um paciente relatou sintomas que ocorreram 3 dias após o tratamento.
Os profissionais de saúde devem aconselhar os pacientes em cada infusão de Lemtrada a procurar atendimento médico imediato de emergência se apresentarem sintomas de acidente vascular cerebral isquêmico ou hemorrágico ou dissecção arterial cervicocéfala. O diagnóstico é frequentemente complicado porque os primeiros sintomas, como dores de cabeça e pescoço, não são específicos. Avalie prontamente os pacientes que se queixam de sintomas consistentes com essas condições.
Nos quase cinco anos desde que a FDA aprovou
a Lemtrada em 2014 para tratar formas reincidentes de EM, identificamos 13 casos mundiais de AVC isquêmico e hemorrágico ou dissecção arterial que ocorreram logo após o paciente ter recebido Lemtrada (ver Resumo dos Dados). Esse número inclui apenas os relatórios enviados ao FDA *, portanto, casos adicionais que desconhecemos podem ter ocorrido. Doze desses casos relataram sintomas dentro de 1 dia após o recebimento de Lemtrada. Como resultado, adicionamos uma nova advertência sobre esse risco na seção Advertências e Precauções da informação de prescrição no rótulo do medicamento. Também acrescentamos o risco de acidente vascular cerebral ao aviso em caixa existente, o aviso mais proeminente da FDA.
Para ajudar a FDA a acompanhar os problemas de segurança com medicamentos, pedimos aos profissionais de saúde que relatem os efeitos colaterais da Lemtrada ou de outros medicamentos ao programa FDA MedWatch, usando as informações contidas na caixa “Contato da FDA” na parte inferior desta página.